Farmacocinética (FC) de los antimicrobianos
Share this step
El resultado de una infección bacteriana viene determinado por muchos factores, en la mayoría de los cuales no puede influir el médico:
- la virulencia del microorganismo y la resistencia a los antibióticos
- la respuesta inmune del hospedador
- la propiedades farmacodinámicas (FD) del antimicrobiano
Un factor que es, hasta cierto punto, susceptible de modificación por parte del profesional sanitario es la farmacocinética (FC) del antimicrobiano.
La FC se define del siguiente modo:
«las interacciones características entre un fármaco y el organismo en términos de su absorción, distribución, metabolismo y excreción» (Merriam-Webster) o, de forma menos científica, como «lo que le hace el organismo al fármaco»; por el contrario, la farmacodinámica es «lo que le hace el fármaco al organismo».
A pesar de que no podemos influir en el metabolismo de un fármaco específico, podemos incidir en la forma en que se administra (la vía, la hora del día, la dosis, la frecuencia y la velocidad de administración).
Con el aumento reciente en la prevalencia de bacterias multirresistentes en muchas partes del mundo y la ausencia de nuevos antibióticos en un futuro inmediato, hay un interés creciente en optimizar la administración de los antibióticos ya existentes con el fin de mejorar los resultados de los pacientes (especialmente en los críticos), reducir la toxicidad y evitar o, al menos, disminuir la posibilidad de selección y aparición de resistencias a los antimicrobianos.
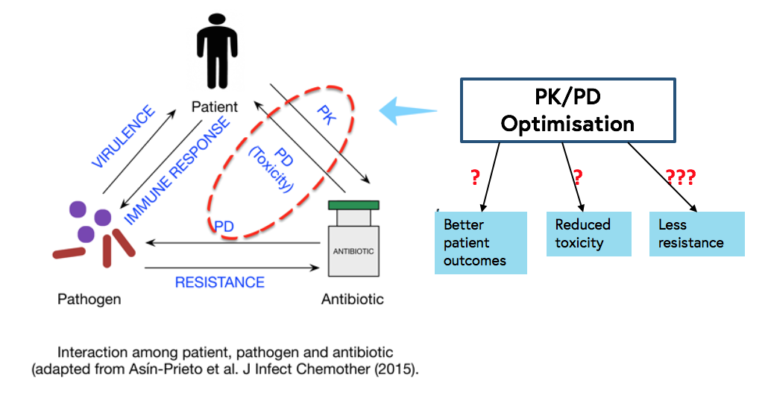
Para optimizar la FC/FD de un antibiótico se requiere un buen conocimiento básico de la FC/FD en distintas poblaciones de pacientes. Es importante tener en mente que la FC/FD de un fármaco específico puede ser distinta en recién nacidos, niños, ancianos, enfermos críticos, obesos mórbidos o pacientes bajo terapia renal sustitutiva, en distintas etnias o sexos y en los pacientes con enfermedades específicas, como la fibrosis quística, ya que la absorción, distribución, metabolismo y excreción de los fármacos puede variar entre estos grupos.
Lamentablemente, no se dispone de datos detallados sobre la FC/FD para numerosos antimicrobianos «antiguos», ya que estos fueron comercializados cuando no se requerían estos datos para su autorización por parte de las autoridades reguladoras y la capacidad técnica era limitada (p. ej., en lo que respecta a la medición precisa de los niveles de fármaco y las simulaciones FC/FD informatizadas). Además, es posible que se disponga de datos FC/FD únicamente para poblaciones específicas (p. ej., voluntarios sanos) y, por tanto, puede resultar difícil extrapolarlos a otras poblaciones.
La monitorización farmacoterapéutica (MFT), es decir, la determinación de la concentración de un fármaco en un líquido corporal (generalmente en sangre) se ha ido incorporando a muchos antimicrobianos, lo que ha facilitado en gran medida las tareas de optimización de la FC/FD, ya que incluso en una población de pacientes específica hay grandes variaciones interindividuales en la FC.
El efecto de los antibióticos en las bacterias –es decir, la eliminación de los microorganismos o la inhibición de su crecimiento– se puede describir fundamentalmente mediante tres índices FC/FD, que relacionan los parámetros farmacocinéticos con los parámetros microbiológicos:
-
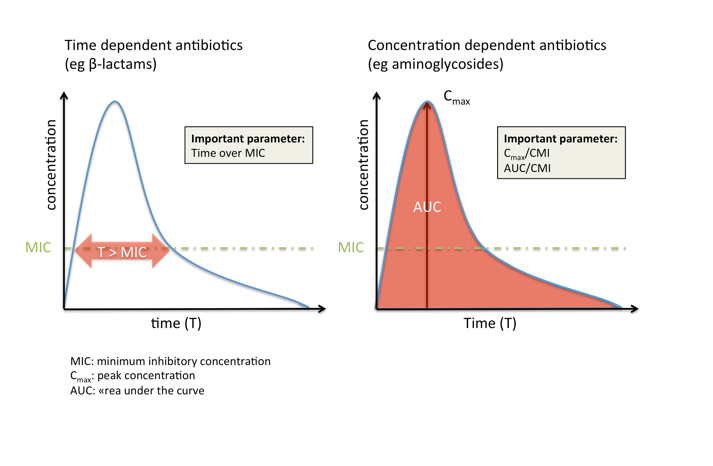
El tiempo durante el cual la concentración de antibiótico (libre) en el lugar de la infección es superior a la concentración mínima inhibitoria (CMI), de forma abreviada «tiempo por encima de la CMI» o simplemente «T>CMI».
-
El cociente de la concentración máxima (Cmáx) de antibiótico (libre) en el lugar de la infección y la concentración mínima inhibitoria (CMI): Cmáx/CMI
-
El cociente del «área bajo la curva (concentración-tiempo)» (AUC) durante 24 horas y la CMI (AUC0-24/CMI).
Los antibióticos se pueden clasificar, en términos generales, en función del índice FC/FD que mejor prediga su eficacia:
-
Los antibióticos dependientes del tiempo, como los betalactámicos, son más efectivos si su concentración se mantiene durante el máximo tiempo posible (al menos durante el 50-60 % del intervalo entre dosis para los betalactámicos) por encima de la CMI. Un aumento en la concentración de más de cuatro o cinco veces la CMI no suele afectar a la eficacia, aunque puede aumentar la toxicidad (p. ej., convulsiones).
-
Por el contrario, los antibióticos dependientes de la concentración, como los aminoglucósidos, son más efectivos si alcanzan una alta concentración en comparación con la CMI en el lugar de infección, mientras que el tiempo durante el que se mantiene esta concentración es menos importante.
-
Muchas clases de antibióticos (p. ej., los glicopéptidos y las fluoroquinolonas), sin embargo, forman parte de la tercera categoría, en la que la eficacia depende tanto de la concentración como del tiempo.
A pesar de que estos principios se aplican, en teoría, a todos los fármacos, la optimización de la FC/FD se ha aplicado principalmente, en la práctica clínica, a los betalactámicos y los aminoglucósidos.
Perfusión continua o prolongada de betalactámicos
Teniendo en cuenta los principios expuestos anteriormente, mucha gente defiende actualmente la administración de los antibióticos betalactámicos mediante infusiones prolongadas (más de una hora y menos de 24 horas) o continua con el fin de maximizar el T>CMI.
En caso de elegir esta estrategia, resulta fundamental administrar una dosis de carga para asegurar que se alcanzan rápidamente los niveles deseados (de otro modo podría tardarse mucho en alcanzar la concentración deseada).
Asimismo, se debe tener en cuenta la estabilidad del antibiótico. Mientras que algunos fármacos son estables durante 24 horas a temperatura ambiente (p. ej., piperacilina o tazobactam), otros solo son estables durante tres o cuatro horas (p. ej., imipenem), por lo que requieren cambios frecuentes de la perfusión (si se administra como infusión continua) o bien la administración en forma de infusión prolongada (en lugar de continua).
También se deben tener en cuenta las incompatibilidades con otros fármacos administrados por vía intravenosa, así como los problemas prácticos (movilidad de los pacientes, número de vías disponibles). A pesar de que el concepto de la perfusión prolongada o continua de betalactámicos (combinada con la MFT) resulta atractivo y se fundamenta en una base teórica robusta, cabe mencionar que la evidencia clínica de que la optimización de la FC/FD provoca una mejora en los resultados de los pacientes sigue siendo débil; es posible que las ventajas de la optimización de la FC/FD se apliquen principalmente a las infecciones por microorganismos que presentan altas CMI frente a la mayoría de betalactámicos (p. ej., Pseudomonas aeruginosa, enterobacterias productoras de carbapenemasa, etc.).
Un ensayo multicéntrico, controlado y aleatorizado realizado recientemente que comparaba la administración de un antibiótico β-lactámico mediante infusión continua frente a intermitente en pacientes con sepsis grave no pudo mostrar una superioridad de la infusión continua en lo que respecta a los días con vida fuera de la UCI en el Día 28, la mortalidad a los 90 días, la curación clínica 14 días tras la finalización del tratamiento antibiótico, días con vida y sin fallo orgánico en el Día 14 y la duración de la bacteriemia. (Dulhunty y cols.)
Además, se justifica con cierto escepticismo en cuanto a si esta estrategia incide de forma importante en el control de las resistencias a los antimicrobianos. No obstante, y teniendo en cuenta que las desventajas son mínimas, la perfusión continua o prolongada de betalactámicos se ha convertido en el tratamiento de referencia en algunos centros, y esperamos que pronto surjan datos sobre su utilidad.
Aminoglucósidos
La MFT para esta clase de fármacos hace tiempo que forma parte de la rutina en la práctica clínica en muchos centros, principalmente con el objetivo de disminuir la toxicidad (especialmente la nefrotoxicidad y la ototoxicidad).
Los aminoglucósidos son el típico ejemplo de antibióticos dependientes de la concentración, con el cociente Cmáx/CMI (>ocho a diez para una eficacia óptima) como el índice FC/FD más importante, lo que hace que la administración de una única dosis diaria de esta clase de fármacos sea la opción lógica.
Además, este modo de administración puede reducir la nefrotoxicidad. Sigue habiendo una cierta incertidumbre sobre el modo óptimo de administración cuando se desea una sinergia con antibióticos betalactámicos frente a microorganismos Gram positivos, como ocurre en el tratamiento de la endocarditis enterocócica (las recomendaciones de 2015 para la endocarditis en los EE. UU. y Europa, por ejemplo, difieren en lo que respecta a esta cuestión).
Teniendo en cuenta los resultados obtenidos en estudios con animales, sigue defendiéndose la administración de varias dosis al día de aminoglucósidos para estas situaciones, a pesar de que las recomendaciones actuales suelen recomendar la administración de dos dosis diarias en lugar de tres, y algunas incluso recomiendan la dosis única, incluso para las infecciones por bacterias Gram positivas. Si se utiliza una única dosis diaria, no es necesario controlar los niveles máximos, ya que la alta dosis administrada asegura una concentración máxima suficiente. Únicamente se deben controlar los niveles mínimos para descartar la acumulación del fármaco y, por tanto, la posible toxicidad.
Share this
Optimización del uso de antimicrobianos: Gestión de la resistencia a los antimicrobianos

Optimización del uso de antimicrobianos: Gestión de la resistencia a los antimicrobianos


Reach your personal and professional goals
Unlock access to hundreds of expert online courses and degrees from top universities and educators to gain accredited qualifications and professional CV-building certificates.
Join over 18 million learners to launch, switch or build upon your career, all at your own pace, across a wide range of topic areas.
Register to receive updates
-
Create an account to receive our newsletter, course recommendations and promotions.
Register for free







