Farmacocinética (Pk) dos Antimicrobianos
Share this step
O resultado de uma infecção bacteriana é determinado por muitos fatores, muitos dos quais não podem ser influenciados pelos médicos:
-
virulência do organismo e resistência aos antibióticos
-
resposta imune do hospedeiro
-
propriedades farmacodinâmicas (PD) dos antimicrobianos.
Um fator que é passível de algum grau de modificação pelo profissional de saúde é a farmacocinética (PK) do antimicrobiano.
PK é definido como::
“As interações características de uma droga e o corpo em termos de absorção, distribuição, metabolismo e excreção” (Merriam-Webster”), ou menos cientificamente como ‘o que o corpo faz com o fármaco’, em oposição a farmacodinâmica, que é “o que a droga faz ao corpo”.
Embora não possamos influenciar a forma como um medicamento específico é metabolizado, podemos influenciar a forma como administramos um medicamento (a via, a hora do dia, a dose, a frequência e a velocidade de administração).
Com o recente aumento na prevalência de bactérias multirresistentes em muitas partes do mundo e a falta de novos antibióticos no futuro previsível, tem havido um interesse crescente em otimizar a administração dos antibióticos existentes, a fim de melhorar os resultados dos pacientes (especialmente em pacientes gravemente enfermos), reduzindo a toxicidade e prevenindo, ou pelo menos diminuindo a probabilidade de seleção e emergência de resistência antimicrobiana.
| Figura da esquerda: | Figura da Direita: |
| Paciente x Patógeno x Antibiótico | Otimização do PK/PD |
| Vrulência / resposta imune | Melhor desfecho para o paciente |
| PK / PD | Redução da toxicidade |
| Resistência | Menos resistência |
Para otimizar a PK / PD de antibióticos, é necessário um bom conhecimento básico sobre PK / PD em diferentes populações de pacientes. É importante ter em mente que a PK / PD de um medicamento específico pode diferir entre recém-nascidos, crianças, idosos, pessoas gravemente doentes, obesos mórbidos, pacientes em terapia de substituição renal, diferentes etnias, gênero e pacientes com doenças como a fibrose cística, uma vez que a absorção, distribuição, metabolismo e excreção de drogas podem variar entre esses grupos.
Infelizmente, faltam dados detalhados de PK / PD para vários antimicrobianos “antigos” uma vez que foram comercializados em um momento em que tais dados não eram exigidos pelas autoridades reguladoras e as capacidades técnicas eram limitadas (por exemplo, com relação à dosagem de níveis séricos precisos de medicamentos e PK/PD simulados por computadores). Além disso, os dados de PK / PD podem existir apenas para populações específicas (por exemplo, voluntários saudáveis) e podem ser difíceis de extrapolar para outras populações.
A monitorização terapêutica de fármacos (TDM) – isto é, a determinação da concentração de um fármaco num fluido corporal (geralmente o sangue) – tornou-se disponível para muitos antimicrobianos, facilitando grandemente a tarefa de optimização de PK / PD; já que, mesmo dentro de uma população de pacientes específica, há grandes variações interindividuais na farmacocinética.
O efeito dos antibióticos sobre as bactérias – ou seja, a morte dos microrganismos ou a inibição do seu crescimento – pode ser descrito principalmente por três índices de PK / PD que colocam os parâmetros farmacocinéticos em relação aos parâmetros microbiológicos:
-
O tempo em que a concentração de antibiótico (livre) no local da infecção é maior do que a concentração inibitória mínima (CIM), abreviado “tempo sobre CIM” ou apenas “T>CIM”
-
A relação entre a concentração máxima (livre) de antibiótico (Cmax) no local da infecção e a concentração inibitória mínima (CIM): Cmax /CIM
-
A razão da área sob a curva (concentração-tempo) (AUC) ao longo de 24h para o CIM (AUC0-24 /CIM).
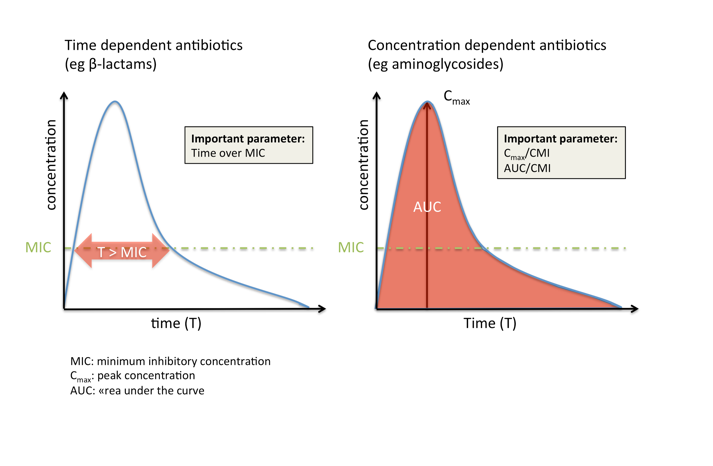
Os antibióticos podem ser amplamente classificados com base no índice PK / PD que melhor preveja a sua eficácia:
-
Antibióticos dependentes do tempo, como os beta-lactâmicos, são mais eficazes se a concentração for mantida o maior tempo possível (mas pelo menos 50-60% do intervalo de dosagem para beta-lactâmicos) acima do CIM(MIC). Um aumento na concentração mais de quatro a cinco vezes do CIM(MIC) não costuma influenciar a eficácia, mas pode aumentar a toxicidade (por exemplo, convulsões).
-
Por outro lado, os antibióticos dependentes de concentração, como os aminoglicosídeos, são mais eficazes se atingirem uma concentração alta em comparação com a CIM no local da infecção, enquanto o tempo que mantêm essa concentração é menos importante.
-
Muitas classes de antibióticos (por exemplo, glicopeptídeos e fluoroquinolonas) caem, entretanto, na terceira categoria, onde a eficácia depende tanto da concentração quanto do tempo.
Embora esses princípios teoricamente se apliquem a todas as drogas/medicamentos, a otimização PK / PD tem sido mais aplicada na prática clínica em relação aos beta-lactâmicos e aminoglicosídeos.
Infusão contínua ou prolongada de beta-lactâmicos
Com base nos princípios mencionados acima, muitos agora defendem a administração de antibióticos beta-lactâmicos através de infusões prolongadas (mais de uma hora porém menos de 24 horas) ou infusões contínuas para maximizar T> MIC.
Se esta abordagem for escolhida, é essencial administrar uma dose de ataque para assegurar que os níveis alvo sejam atingidos rapidamente (caso contrário, pode levar muito tempo para alcançar a concentração alvo desejada).
Além disso, a estabilidade do antibiótico deve ser considerada. Enquanto algumas drogas são estáveis por 24 horas à temperatura ambiente (piperacilina / tazobactam), outras permanecem estáveis por três a quatro horas (por exemplo, imipenem), exigindo alterações freqüentes da infusão (se administrada em infusão contínua) ou administração prolongada ( em vez de contínuo).
Incompatibilidades com outros medicamentos administrados por via intravenosa e questões de ordem prática (mobilidade dos pacientes, número de linhas disponíveis) também precisam ser consideradas. Enquanto o conceito de infusão contínua ou prolongada de beta-lactâmicos (combinado com TDM) é atraente e baseado em uma base teórica forte e racional, é necessário mencionar que a evidência clínica de que a otimização PK / PD leva a melhores resultados é relativamente fraca; É concebível que as vantagens da otimização de PK / PD se apliquem primariamente a infecções com organismos que têm MICs/CIMs relativamente altas a muitos beta-lactâmicos (por exemplo, Pseudomonas aeruginosa, Enterobacteriaceae produtoras de carbapenemases, etc.).
Um recente estudo multicêntrico randomizado controlado comparando a administração de antibióticos β-lactâmicos por infusão contínua versus intermitente em pacientes com sepse grave não mostrou superioridade da infusão contínua em relação aos dias com vida livres de UTI no 28º dia, mortalidade em 90 dias, cura clínica 14 dias após a cessação dos antibióticos, dias livres com vida de falência de órgãos no 14º dia e duração da bacteremia. (Dulhunty et al)
Além disso, algum ceticismo é justificado se esta abordagem tem um grande impacto no controle da resistência antimicrobiana. No entanto, dado que as desvantagens são mínimas, a perfusão contínua ou prolongada de beta-lactâmicos tornou-se padrão de cuidados em alguns centros e esperamos que em breve apareçam provas para a sua utilidade.
Aminoglicosídeos
O TDM para esta classe de medicamentos tem se tornado prática clínica de rotina em muitos centros, principalmente com o objetivo de diminuir a toxicidade (principalmente nefro e ototoxicidade).
Os aminoglicosídeos são o exemplo clássico de antibióticos dependentes de concentração com Cmax / MIC (> oito a dez para eficácia máxima) como o mais importante índice de PK / PD, fazendo com que a dosagem única diária dessa classe de medicamentos seja a escolha lógica.
Além disso, este modo de administração também pode reduzir a nefrotoxicidade. Permanece alguma incerteza com relação ao modo ideal de administração quando a sinergia com antibióticos beta-lactâmicos contra organismos Gram-positivos é desejada, como para o tratamento de endocardite enterocócica (as diretrizes de endocardite americana e europeia de 2015, por exemplo, diferem nesta questão).
Com base em estudos em animais, a administração diária múltipla de aminoglicosídeos ainda é recomendada para essas situações, embora atualmente as diretrizes recomendem doses duas vezes ao dia, em vez de três doses diárias, e algumas diretrizes favorecem uma dose diária única mesmo para infecções por Gram positivos. Se for utilizada uma dose diária única, os níveis de pico não precisam ser monitorizados, uma vez que a dose elevada administrada assegura concentrações de pico adequadas. Apenas os níveis mínimos precisam ser monitorados para descartar o acúmulo do medicamento e, portanto, a toxicidade potencial.
Share this
Stewardship de Antimicrobianos: Gerenciamento da Resistência Antimicrobiana

Stewardship de Antimicrobianos: Gerenciamento da Resistência Antimicrobiana


Reach your personal and professional goals
Unlock access to hundreds of expert online courses and degrees from top universities and educators to gain accredited qualifications and professional CV-building certificates.
Join over 18 million learners to launch, switch or build upon your career, all at your own pace, across a wide range of topic areas.
Register to receive updates
-
Create an account to receive our newsletter, course recommendations and promotions.
Register for free







